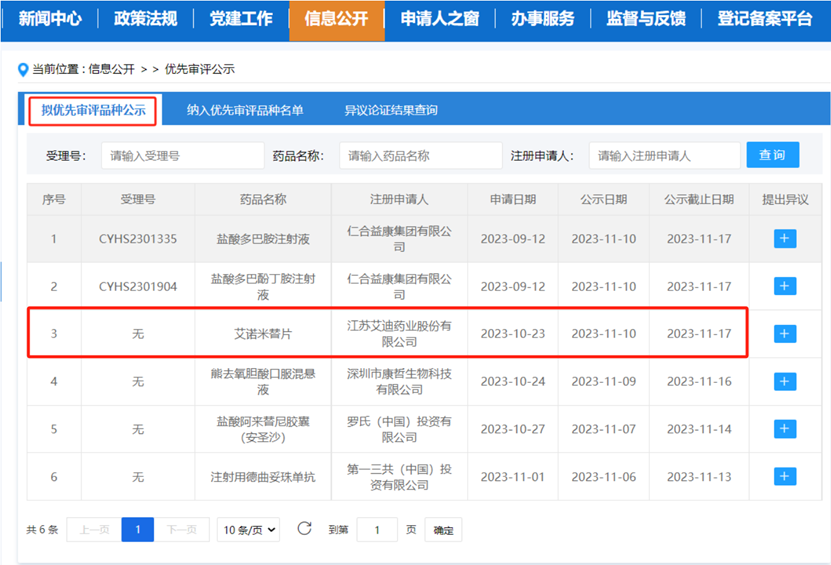
江苏艾迪药业股份有限公司(以下简称“公司”)抗艾滋病领域在研1类新药复邦德®(艾诺米替片)拟用于新适应症——“转换治疗经治获得病毒抑制的HIV-1感染者”的药品上市许可申请近日被国家药品监督管理局药品审评中心(CDE)纳入拟优先审评品种公示名单。此次被纳入拟优先审评名单,将有助于药品早日获批,为HIV患者提供全新的治疗选择,助力其重获健康和希望。
艾诺米替片系公司开发的国内首个具有自主知识产权的三联单片复方抗艾滋病1类新药,是在艾诺韦林片(研发代码:ACC007,商品名:艾邦德®)的基础上加入两个核苷类骨干药物——替诺福韦(TDF)和拉米夫定(3TC)所组成的药物。其中,艾诺韦林片为公司研发的抗HIV治疗的第三代非核苷类逆转录酶抑制剂(NNRTIs),于2021年6月25日在国内获批上市,TDF、3TC为治疗HIV的核苷类逆转录酶抑制剂(NRTIs)。
在保障病毒抑制效果的基础上,艾诺米替片作为口服单片复方制剂,HIV感染者每天仅需服用1片,无需再服用其它抗艾滋病药物,可以显著减轻患者服药负担,降低服药场景的识别度,增加依从性,减少耐药发生。
公司于2020年7月29日获得国家药品监督管理局核准签发的《药物临床试验批准通知书》,同意公司就艾诺米替片治疗经治的HIV-1感染者开展Ⅲ期临床试验。经与CDE沟通,确定了艾诺米替片的Ⅲ期临床试验方案为与进口原研药物整合酶抑制剂艾考恩丙替片(商品名:捷扶康®,由美国吉利德公司研发,我国首个纳入医保、广泛使用的抗HIV创新单片复方制剂)开展头对头试验。2022年3月末,完成全部762例受试者的入组工作。2023年6月,Ⅲ期临床试验顺利完成48周主要有效性研究。2023年7月,公司已取得艾诺米替片(转换治疗经治获得病毒抑制的HIV-1感染者)Ⅲ期临床试验总结报告。
根据艾诺米替片Ⅲ期临床试验数据显示,与艾考恩丙替片相比,艾诺米替片对于获得病毒抑制的HIV感染者可以持久维持病毒抑制且有效性相当。与此同时,从安全性分析数据中也可以看到艾诺米替的不良事件(ADR)发生率低于艾考恩丙替组(74.0%vs86.9%,P<0.001),尤其艾诺米替3-5级ADR发生率3.9%,远低于对照组的18.1%(P<0.001)。其中在血脂、体重及尿酸等心血管代谢安全性指标方面艾诺米替的优势更为明显,如在严重程度≥3级的不良反应发生率中,血甘油三酯升高艾诺米替组是1.0%,而艾考恩丙替是10.0%。而在肝脏和肾脏安全性方面,两组相当。
多年来,艾迪药业始终专注于抗艾滋病药物研发,公司目前正在对标国际先进标准,致力于打造完整的抗HIV新药研发管线,力求为患者提供更为全面多元的药物选择。除艾诺韦林片、艾诺米替片之外,公司研发管线还覆盖了整合酶抑制剂(ACC017)、长效治疗药物(ACC027)等治疗靶点。艾迪药业将持续加强推进抗艾滋病新药开发,满足全球抗艾领域日益增长的市场需求。
什么是优先审评?
药品上市许可优先审评审批是国家为鼓励研究和创制新药、解决临床急需短缺药品等而设立的药品快速上市通道。2020年7月,国家药品监督管理局发布《药品上市许可优先审评审批工作程序(试行)》,明确列出六大类情况可申请适用优先审评审批,包括具有明显临床价值的临床急需短缺药品、突破性治疗药物、附条件批准、儿童用药等情形都可通过优先审评审批程序来加快审评、审批。优先审评审批的适用对象虽然经过多次变革,但万变不离其宗的是该程序始终坚持以患者为中心,以临床价值为导向。近年来,越来越多的重磅创新产品通过这一“绿色通道”加快了上市进程。

